化学之海水应用知识点
推荐文章
化学之海水应用知识点有哪些
化学近年来中考的另一个特点是阅读量和简答题分量增大。对于阅读量大的题目,一些同学由于题目看不懂而失分。因此首先要加强阅读能力的培养。下面是小编给大家带来的化学之海水应用知识点,欢迎大家阅读参考,我们一起来看看吧!
初中化学知识点:海水中的资源
海水中的物质:
海水中水约占总质量的96.5%,可溶性盐约占3.5%,含量址多的盐是氯化钠。其中Cl-:55.06%, Na+:30.61%,SO42-:7.67%,Mg2+:3.69%,Ca2+:1.15%,K+:1.01%,其他:0.72%。
海洋资源:
化学资源:海水中已发现的元素有80 多种,其中O,H,Cl,Na,Mg 等元素含量较多
水资源:通过海水淡化可获取淡水
动力资源:潮汐能、温差能等
生物资源:鱼类及其他海产品
矿物资源:可燃冰、多金属结核
海水淡化:
即利用海水脱盐生产淡水。是实现水资源利用的开源增量技术,可以增加淡水总量,且不受时空和气候影响,水质好、价格渐趋合理,可以保障沿海居民饮用水和工业锅炉补水等稳定供水。从海水中取得淡水的过程谓海水淡化。现在所用的海水淡化方法有海水冻结法、电渗析法、蒸馏法、反渗透法,目前应用反渗透膜的反渗透法以其设备简单、易于维护和设备模块化的优点迅速占领市场,逐步取代蒸馏法成为应用最广泛的方法。
海水淡化常用方法:
1. 蒸馏-冷凝法,装置如下图。
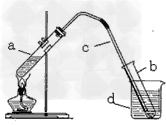
(1)实验仪器药品:酒精灯、试管、单孔橡皮塞、玻璃导管、铁架台、烧杯、胶头滴管、海水、硝酸银溶液
(2)步骤:
1)按上图组装仪器,并检查装置气密性
2)像a试管中加入5—10mL海水,塞好橡皮塞,用酒精灯加热;一段时间后a试管中溶液沸腾,b中逐渐有无色透明液体生成。
3)一段时间后拆除装置,向B试管滴加硝酸银,无白色沉淀产生。
(3)结论:蒸馏能使海水淡化。
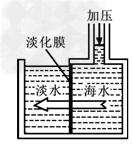
2. 膜分离技术淡化海水:
膜法淡化海水是利用一种只允许水分子通过而不允许盐类的离子通过的高分子膜,像过筛子一样把水和溶解在海水中的盐分离的方法,其原理是将海水加压,海水中的水分子通过淡化膜,从而使海水得到淡化。
3. 结晶法
是在海水中加入极易挥发的物质丁烷,丁烷挥发带走海水的热量使海水结冰,从而使海水和盐分分离。
初中化学知识点:海水“制碱”的原理和过程
氨碱法——索尔维制碱法:
本法以食盐和石灰石为原料,以氨气为媒介来生产纯碱,生产能力大,产品质量好,纯度高(纯碱即由此得名)。
侯氏制碱法:
联合制碱法是我国化学家侯德榜先生于四十年代研究成功的制碱新工艺,又称"侯氏制碱法".与氨碱法相比,联合制碱法工艺进步了很多.此法保持了氨碱法的优点,消除了它的缺点.一方面使食盐的利用率提高到96%;另一方面生产出的NH4Cl可做氮肥,是一种制碱和制氨相结合的联合生产方法.
a)海水“制碱”的方法称为:氨碱法——索尔维制碱法
(1)原理:NH3+H2O+CO2==NH4HCO3 ;NH4HCO3+NaCl==NH4Cl+NaHCO3↓
2NaHCO3![]() Na2CO3+H2O+CO2↑;然后2NH4Cl+Ca(OH)2==2NH3↑+CaCl2+H2O
Na2CO3+H2O+CO2↑;然后2NH4Cl+Ca(OH)2==2NH3↑+CaCl2+H2O
(2)过程:将饱和的食盐溶液在冷却时用氨饱和后在加压下通入CO2(由CaCO3分解而来),由于NaHCO3
溶解度较小而析出,将析出的NaHCO3晶体煅烧,即可制得碳酸钠。母液中的氯化铵加消石灰回收氨,以便循环利用。制氨盐水先通入氨气,再通二氧化碳。因为氨气的溶解度大,若先通二氧化碳,则有大部分没有溶解到海水中。
b)侯氏制碱法
第一步是:氨气与水和二氧化碳反应生成一分子的碳酸氢铵。
第二步是:碳酸氢铵与氯化钠反应生成一分子的氯化铵和碳酸氢钠沉淀,碳酸氢钠之所以沉淀是因为它
的溶解度较小。根据NH4Cl在常温时的溶解度比NaCl大,而在低温下却比NaCl溶解度小的原理,
在278K~283K(5℃~10℃)时,向母液中加入食盐细粉,而使NH4Cl单独结晶析出供做氮肥。
反应方程式:
(1)NH3+H2O+CO2==NH4HCO3
(2)NH4HCO3+NaCl==NH4Cl+NaHCO3↓
(3)2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
即:①NaCl(饱和)+NH3+H2O+CO2==NH4Cl+NaHCO3↓
②2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
氨碱法——索尔维制碱法:
(1)原理:NH3+H2O+CO2==NH4HCO3 ;NH4HCO3+NaCl==NH4Cl+NaHCO3↓
2NaHCO3![]() Na2CO3+H2O+CO2↑;然后2NH4Cl+Ca(OH)2==2NH3↑+CaCl2+H2O
Na2CO3+H2O+CO2↑;然后2NH4Cl+Ca(OH)2==2NH3↑+CaCl2+H2O
(2)过程:将饱和的食盐溶液在冷却时用氨饱和后在加压下通入CO2(由CaCO3分解而来),由于NaHCO3
溶解度较小而析出,将析出的NaHCO3晶体煅烧,即可制得碳酸钠。母液中的氯化铵加消石灰回收氨,以便循环利用。制氨盐水先通入氨气,再通二氧化碳。因为氨气的溶解度大,若先通二氧化碳,则有大部分没有溶解到海水中。
初中化学知识点:海水“晒盐”的原理和过程
概述:
从海水中提取食盐的方法主要是“盐田法”这是一种古老的而至今仍广泛沿用的方法。使用该法。需要在气候温和,光照充足的地区选择大片平坦的海边滩涂,构建盐田。盐田一般分成两部分:蒸发池和结晶池。先将海水引入蒸发池,经日晒蒸发水分到一定程度时,再倒入结晶池,继续日晒,海水就会成为食盐的饱和溶液,再晒就会逐渐析出食盐来。这是得到的晶体就是我们常见的粗盐。剩余的液体称为母液,可从中提取多重化工原料。
海水→蒸发池→结晶池→粗盐和母液
a)原理:海水经日晒、风吹等,使溶剂不断减少,溶质的质量分数逐渐增大,
直至形成饱和溶液,继而析出晶体。
b)过程:先将海水引入蒸发池,经日晒蒸发水分到一定程度时,再引入结晶池,继续日晒,海水就会成为食盐的饱和溶液,再晒,就会析出食盐来。
这时,得到的晶体就是我们常见的“粗盐”,剩余的液体称为母液(或“苦卤”)。
示意图如下:
海水“晒”盐:
1. 原理:海水经日晒、风吹等,使溶剂不断减少,溶质的质量分数逐渐增大,直至形成饱和溶液,继而析出晶体。
2. 过程:先将海水引入蒸发池,经日晒蒸发水分到一定程度时,再引入结晶池,继续日晒,海水就会成为食盐的饱和溶液,再晒,就会析出食盐来。
这时,得到的晶体就是我们常见的“粗盐”,剩余的液体称为母液(或“苦卤”)。
示意图如下:
